Ove se godine navršava 150 godina od otkrića Periodnog sustava elemenata, stoga je Opća skupština Ujedinjenih naroda proglasila 2019. godinu Godinom Periodnog sustava elemenata. Da bismo i mi podsjetili na važnost toga otkrića, ukratko ćemo se osvrnuti na znanstvenike koji su pokušavali svrstati kemijske elemente nekim suvislim redom kao i na tablicu periodnog sustava koja je jedno od najvažnijih pomagala pri proučavanju kemije.
Biti genije, gledati na pojedine pojave dalje i drugačije, značajka je maloga broja ljudi. Za razvoj takva načina promišljanja često je zaslužno obiteljsko okruženje. Majka, Marija Dimitrijevna, vlasnica tvornice stakla i otac, Ivan Pavlovič, ravnatelj gimnazije djelovali su na malog Dmitrija Mendeljejeva da se zainteresira za prirodoslovlje, a posebno za kemiju.
Nakon završenog fakulteta, Dmitrij Ivanović Mendeljejev magistrirao je u Sankt Peterburgu 1856., a doktorirao 1865. godine. Od 1859 do 1861. godine boravio je u Heidelbergu u Njemačkoj gdje proučava svojstva tekućina pri promjenama tlaka i temperature. Sudjelovao je u radu Prvog međunarodnog kongresa kemičara u Karlsruheu 1860. godine i slušao predavanje talijanskog kemičara S. Cannizzara o metodi određivanja atomskih težina. To ga se predavanje jako dojmilo. Ubrzo nakon doktorata postao je profesorom opće, anorganske, organske i tehničke kemije na petrogradskom sveučilištu. Potreba za odgovarajućim udžbenikom usmjerila ga je na proučavanje povezanosti do tada poznata 63 kemijska elementa i njihovih spojeva. Rezultat toga rada bio je udžbenik Osnove kemije (Osnovi himii, I – II, 1869. - 71.), a 1869. godine izdao je i tablicu periodnog sustava. Međutim, nije Mendeljejev bio prvi koji je uočio povezanost između do tada malog broja poznatih kemijskih elemenata. Bio je tu J. W. Döbereiner sa svojim prijedlogom trijada (Cl, Br, I – S, Se, Te – Ca, Sr, Ba) (1865.). J. A. R. Newlands svrstao je elemente u redove od po 8 elemenata – Zakon oktava – (1864.) za koji je bio ismijan od svojih suvremenika. Iako Newlandsova teorija nije naišla na odobravanje u njegovo vrijeme, njegova je zamisao postavila temelje za shvaćanje današnjega poretka elemenata. Ta je zamisao bila inspiracija L. Mayeru i D. I. Mendeljejevu, koji su istodobno pravilno uočili periodičnu povezanost među poznatim kemijskim elementima na temelju rastućih atomskih „težina“ (danas: masa) i koji su do kraja riješili zagonetku o svrstavanju kemijskih elemenata u uređen sustav.
Svoj prvi prikaz periodičnosti elemenata Mendeljejev je predstavio Ruskom kemijskom društvu 1869. godine u radu „Ovisnost između relativne atomske mase i položaja elemenata u tablici“, prema kojoj elementi svrstani prema rastućim atomskim masama daju periodični raspored. Opazio je, naime, da se svojstva elemenata poredana na taj način nakon određenog broja elemenata ponavljaju, pa ih je svrstao u periode i prvi objavio zakon periodičnosti. Time su elementi sličnih kemijskih svojstava tvorili uspravne stupce. Svoja saznanja o periodnim zakonitostima elemenata upotrijebio je za predviđanje svojstava još neotkrivenih elemenata (skandija, galija i germanija) za koje je ostavio prazna mjesta u tablici. Osim toga shvatio je da atomska masa ne smije biti jedini kriterij za svrstavanje elemenata, već da treba uzeti u obzir i svojstva elemenata kako bi se uklopili u odgovarajući stupac. Jedan je od primjera za to položaj argona i kalija u tablici u kojoj je kalij (iako lakši) svrstao iza argona, dakle pravilno u stupac s alkalijskim metalima kojima i pripada dok je argon na taj način pravilno stavljen među plemenite plinove. Upravo ta sposobnost predviđanja svojstava elemenata, koja su se pokazala točnima, razlog su da se danas Mendeljejeva, a ne Mayera smatra tvorcem periodnog sustava elemenata. Iako je 1906. godine predložen, nikada za svoje otkriće nije dobio Nobelovu nagradu, ali je dobio niz priznanja diljem svijeta. Njegova tablica periodnoga sustava elemenata postala je osnovicom za razumijevanje temeljnih zakonitosti kemije, građe elemenata i spojeva i njihovih reakcija.
Suvremena tablica periodnoga sustava, prema preporuci Međunarodne unije za čistu i primijenjenu kemiju (IUPAC, 1988), sadrži 7 perioda i 18 skupina elemenata. Elementi su u periodnome sustavu označeni kemijskim simbolima, kojima se dodaju atomski ili redni broj kao lijevi supskript, a nukleonski ili maseni broj kao lijevi superskript. Danas poznajemo 118 kemijskih elemenata čime je tablica Periodnog sustava elementa u potpunosti popunjena (svih 7 perioda). Prema svojstvima dijelimo elemente na metale, polumetale i nemetale.
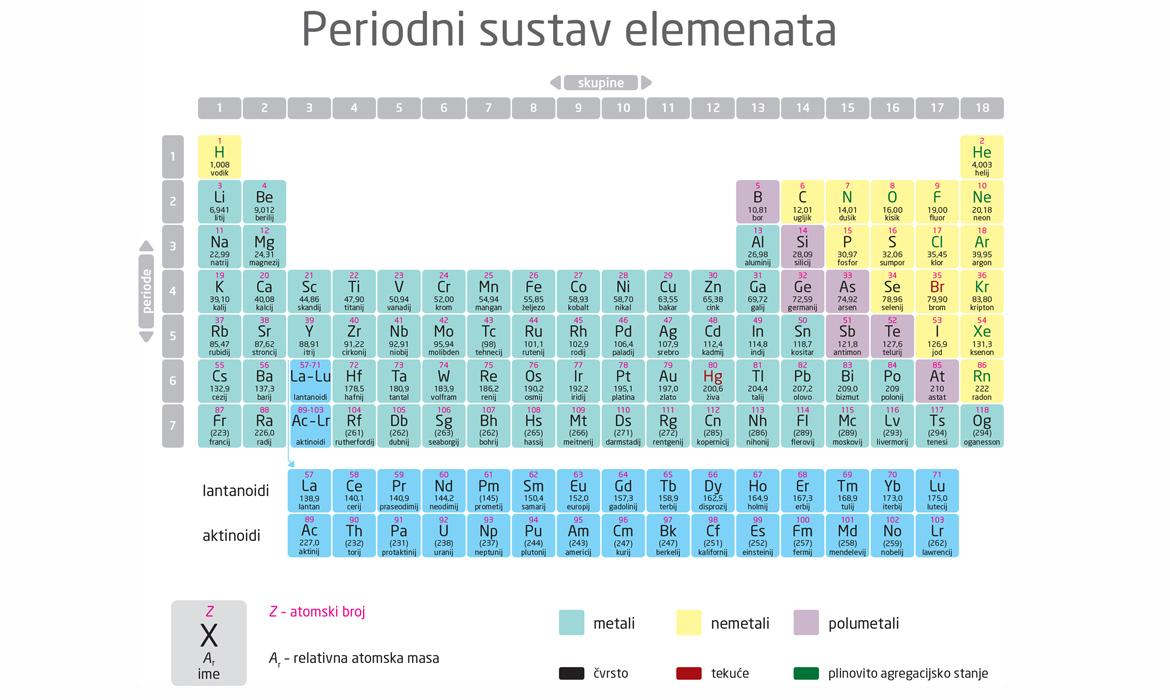
Glavne skupine periodnoga sustava jesu: 1., 2., 13., 14., 15., 16., 17. i 18. Elementi 1. skupine (osim vodika) nazivaju se alkalijski metali jer tvore jake lužine (alkalije). Elementi 2. skupine su zemnoalkalijski metali, jer također tvore jake lužine, a uz to su sastojci Zemljine kore. Elementi 13., 14. i 15. skupine nazivaju se prema prvom elementu u skupini: borova (13), ugljikova (14) i dušikova (15) skupina. Elementi 16. skupine su halkogeni elementi jer ulaze u sastav ruda, elementi 17. skupine su halogeni elementi jer s metalima tvore soli, a elementi 18. skupine nazivaju se plemeniti plinovi jer su u uobičajenim uvjetima jednoatomni plinovi koji ne reagiraju ni s jednim elementom.
Elementi od 3. do 11. skupine zovu se prijelazni metali jer tvore prijelaz između metala i nemetala. Elementi 12. skupine, cink, kadmij i živa, nemaju posebno ime. Unutar šeste periode nalazi se niz kemijski vrlo sličnih elemenata, atomskoga broja 57 – 71, koji se prema prvom članu niza, lantanu, nazivaju lantanoidi, a unutar sedme periode niz također kemijski vrlo sličnih elemenata, atomskoga broja 89 – 103, koji se prema prvom članu niza, aktiniju, zovu aktinoidi. Lantanoidi i aktinoidi nazivaju se i unutrašnji prijelazni elementi i zbog preglednosti najčešće se prikazuju posebno, na dnu tablice. Skandij, itrij i lantanoidi zajedno se nazivaju i rijetke zemlje. (izvor: mrežno mjesto: http://www.enciklopedija.hr )
U današnjoj tablici periodnog sustava elemenata možemo iščitati ili odrediti broj elementarnih čestica za svaki atom (broj protona, neutrona i elektrona), njegovu relativnu atomsku masu, elektronsku konfiguraciju i broj valentnih elektrona. Od ukupnog broja elemenata njih 90 je prirodnih, a ostali su umjetno proizvedeni u laboratorijima.
Zadnje otkrivene elemente, s rednim brojevima 113, 115, 117 i 118, u prosincu 2016. godine je Međunarodna organizacija za čistu i primijenjenu kemiju (IUPAC) službeno uvrstila u tablicu periodnog sustava. Imena za novootkrivene kemijske elemente predložili su znanstvenici koji su ih otkrili. Prva tri kemijska elementa dobila su ime prema mjestu istraživačkog laboratorija u kojima su otkriveni. Tako je nihonij otkriven u Japanu (japanska riječ za Japan je Nippon ili Nihon), moskovij (Moskva) i tenesin (američka savezna država Tennessee). Oganeson je dobio ime u čast ruskog znanstvenika profesora nuklearne fizike Jurja Oganessiana. Sva četiri novootkrivena elementa izrazito su nestabilna zbog vrlo velikog broja protona u njihovim jezgrama. Traju vrlo kratko, njihov životni vijek mjeri se u milisekundama.
U čast Mendeljejevu kemijski element otkriven 1955. godine u laboratoriju u Berkeleyju (Kalifornija), rednog broja 101, nazvan je mendelevijem (Md).

Dmitrij Ivanović Mendeljejev rođen je u Tobolsku, u Sibiru 8. veljače 1834., a umro je 2. veljače 1907. u Sankt Peterburgu. Bio je čovjek velikih ideja, a njegova postignuća važna su za razvoj znanosti u Drugoj industrijskoj revoluciji kao i danas. Zato danas obilježavamo 150 godina od objavljivanja njegove tablice Periodnog sustava elemenata.
Tekst priredila:
Lidija Žišković, prof.
OŠ Marije Jurić Zagorke, Zagreb
U pripremi teksta upotrijebljeni su podatci s mrežnih stranica:
- https://www.chemistryworld.com/opinion/whose-periodic-table-is-it-anyway...
- http://www.enciklopedija.hr/natuknica.aspx?ID=40096
- http://studentski.hr/vijesti/na-danasnji-dan/umro-dmitrij-ivanovic-mende...
- http://www.enciklopedija.hr/natuknica.aspx?ID=47629
- https://edutorij.e-skole.hr/share/proxy/alfresco-noauth/edutorij/api/pro...
- https://www.skolskiportal.hr/clanak/3444-covjek-koji-je-otkrio-periodni-...